
Quand on parle de graphène, de GoreTex ou de Kevlar, on pense tout de suite à des matériaux exotiques aux propriétés dignes d’un film de science-fiction. C’est pas mal pour briller en soirée, mais à quoi ressemblent le Kevlar réellement ? Et quelle est la particularité du GoreTex ? En quoi le graphène est-il le prochain matériau qui va révolutionner le monde ?
Ces exemples ne sont pas les seuls dont on entend parler régulièrement sans en avoir jamais vu ni savoir à quoi ça ressemble. J’ai déjà parlé du plutonium de cette façon, je vais ici aborder une petite liste d’autres matériaux exotiques.
Le kevlar

Tout d’abord, le Kevlar™ est un nom commercial déposé par l’entreprise américaine DuPont qui l’a découvert en 1965. Le nom commun de la molécule de ce produit est le poly(p-phénylènetéréphtalamide) (ou PPPT).
La particularité du kevlar est qu’il possède une très grande résistance à la traction et au cisaillement.
Les propriétés mécaniques des matériaux prennent leur source dans la structure moléculaire. Dans le cas du kevlar, la résistance au cisaillement est assurée par les liaisons-hydrogène entre les différentes fibres du polymère. De plus, la molécule contient elle-même des cycles phényles qui sont très solides, mais qui aussi dans le kevlar interdisent la rotation et la torsion de la molécule, donnant à la structure une résistance à la rupture plus importante que l’acier (tout en étant donc une fibre légère et souple).
Physiquement, le kevlar est une matière plastique : comme tous les plastiques ou presque, il peut donc prendre toutes les formes qu’on lui donne. Dans le cas des gilets pare-balle, des gants en kevlar ou des renforcements pour les pneus ou voiles de bateaux, le kevlar est créé sous la forme d’une toile très dense et dont les fibres très fines sont regroupées en nappes qui sont alors croisées pour augmenter la résistance (photo ci-dessus).
Ce matériau est utilisé dans la protection des personnes (gilets, gants, casques, blousons…) des objets (la Station Spatiale Internationale est protégée des débris cosmiques par du kevlar) et en renforts un peu partout (pneus, bateaux, carrosseries…) à la place des renforcements métalliques, plus lourds et moins souples.
Le graphène
Le graphène (image d’en-tête) est un matériau extrêmement simple dans sa structure : c’est juste une suite d’atomes de carbone assemblés en hexagone. Il est aussi très simple à produire : si vous collez un bout de ruban adhésif sur une mine de crayon, et que vous le retirez, le scotch arrachera une fine pellicule de graphite de la mine de crayon. Cette pellicule, qui, si l’opération est bien faite, mesure un atome d’épaisseur, est en fait une feuille de graphène.
Cette simplicité rudimentaire n’enlève cependant rien à la difficulté plus importante de produire des feuilles de graphène de grande taille — ce qui est d’ailleurs ce qui retarde ses applications à grande échelle.
Le carbone élémentaire a une structure atomique si particulière qu’il peut chimiquement se lier à un très grand nombre d’autres atomes. En fait, il existe plus de molécules différentes centrées sur le carbone qu’il existe de molécules possibles avec tous les autres éléments du tableau périodique. Sous forme pure, là encore, le carbone peut prendre plusieurs structures. Les deux plus connues sont :
- le graphite, comme dans les mines de crayon. Ici, le carbone forme un empilement de petites couches de graphène.
- le diamant : un cristal où les atomes de carbone sont liés dans une structure pyramidale très rigide. Le diamant a ainsi une dureté exceptionnelle, la plus grande de tous les éléments naturels.
Pour en revenir au graphène, c’est la structure sous la forme d’une simple couche de carbone qui lui confère des propriétés pratiques dans tous les domaines imaginables.
Premièrement, il reste un électron non liant de libre sur chaque atome de carbone. Cet électron est libre et il peut donc conduire l’électricité et la chaleur. Mais en plus d’être conducteur, le graphène est le meilleur conducteur électrique qui existe. Bien plus que les conducteurs métalliques. La même remarque peut être faite pour la conduction de chaleur : il est plus conducteur que le cuivre, l’aluminium et le diamant, ce dernier étant déjà un conducteur exceptionnel.
Deuxièmement, le graphène présente une structure avec des liaisons cycliques avec une ouverture au centre. Cette ouverture est également intéressante : elle est juste assez grande pour permettre à une molécule d’eau de passer. Ce n’est qu’un hasard de la nature, mais d’un point de vue pratique ceci est vraiment très intéressant pour désaliniser ou purifier de l’eau dans le but de la rendre potable.
Chimiquement parlant, permettre à un solvant tel que l’eau de passer sans laisser passer le soluté, permet de faire une barrière osmotique. Ceci est utile dans un certain nombre de réactions chimiques, en particulier les piles et accumulateurs électriques à l’heure où le Li-Ion ne suffit plus, ou pour les réactions catalytiques, par exemple dans les dispositifs qui servent à dépolluer l’environnement.
Troisièmement, et je m’arrêterai là, cette fine couche de carbone a une résistance exceptionnelle ! Il faut une traction de 400 tonnes pour déchirer une feuille de graphène de 1 cm². C’est largement plus que l’acier ou l’aluminium, en plus d’être beaucoup plus léger. Concrètement, une feuille de graphène est assez solide pour soutenir le poids d’un éléphant en équilibre sur un crayon : la mine de crayon posée sur la feuille de graphène ne la déchirera pas.
Si l’on enroule une feuille de graphène, on obtient un tube. On les appelle des nano-tubes de carbone, car leur taille est de l’ordre du nanomètre. Sous cette forme, ces tubes peuvent véhiculer des électrons, et donc former un tube conducteur. De nouveau, les électrons libres du carbone repoussent les électrons qui y passent et la conduisent sans résistance électrique, et donc sans chauffer.
Enfin, si on referme un nano-tube de carbone sur lui-même (et en modifiant légèrement la structure) on obtient des fullerènes : des molécules sphériques dont la structure rappelle la géométrie d’un ballon de football :
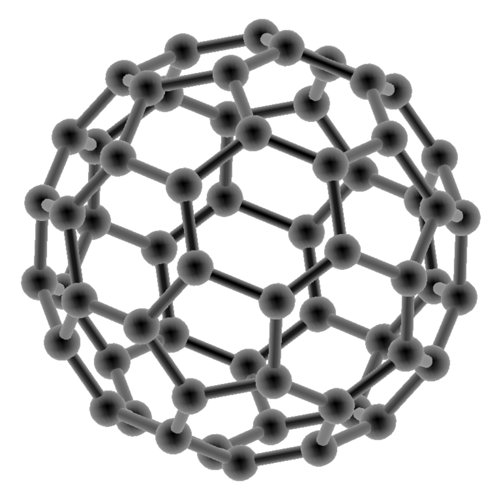
Ce sont des grandes molécules, assez compacts et qui peuvent enfermer d’autres composés. De nouveau, cette structure possède des applications inédites, tant en optique pour le diffraction qu’en mécanique pour la lubrification.
Le Gore-Tex Pyrad
À l’inverse du graphène et à l’instar de l’aérogel, le Pyrad® est un de ces matériaux qui isolent de façon exceptionnelle de la chaleur. Il résulte de l’enchevêtrement de fibres de polytétrafluoroéthylène (PTFE, autrement connu sous le nom commercial Teflon).

Dans la vidéo (lien de l’image), une feuille de Pyrad est placée sur une plaque chauffante et un crayon de cire est placé dessus : le crayon ne fond pas, tant le Pyrad isole la chaleur. Ceci est ici mis à profit dans les PC haut de gamme pour procurer un confort d’utilisation maximal, mais de façon plus « utile », ce textile est utilisé dans certains vêtements ignifugés tels que celui des pompiers ou des combinaisons contre le froid.
Cette propriété d’isoler la chaleur provient d’une structure très aérée des fibres, où l’air et la chaleur entre les fibres ne circule que peu ou pas du tout. La même chose est observée avec la laine, la neige ou les laines de verre ou de roche. Le Pyrad a l’avantage ici de se présenter sous la forme d’une feuille très fine.
À nouveau, le Pyrad® est une marque commerciale déposée, par Gore. Gore avait déjà fait des textiles comme ceux utilisés dans « les chaussures qui respirent », pour empêcher l’eau liquide de rentrer, en étant suffisamment finement structurée pour que la tension de surface de l’eau empêche cette dernière de couler, tout en laissant passer l’eau de la transpiration, qui est sous forme gazeuse.
L’aérogel

Ce matériau relativement célèbre est également un très bon isolant thermique : il est utilisé (comme le Pyrad®) dans les domaines où une très grande isolation est nécessaire, par exemple dans le nez des navettes spatiales pour le protéger de la chaleur très importante dégagée lors de la rentrée dans l’atmosphère. On envisage également de l’utiliser dans le bâtiment, toujours pour l’isolation, même s’il est très cher à produire.
Sa haute porosité lui donne des applications plus spécifiques : comme celui de capturer des polluants ou des poussières. Certaines sondes spatiales ou certains avions qui volent dans la haute atmosphère embarquent des « filets » destinés à capturer la poussière cosmique (en vu d’être analysées). Ces filets sont fait d’aérogel qui capturent les poussières. Sur le même principe, l’aérogel est utilisé pour protéger les astronautes des poussières cosmiques quand ils sont à l’extérieur de la station spatiale.
Ses propriétés thermiques sont à nouveau le résultat d’une grande porosité : l’air emprisonné dans sa structure aérée conduit très peu la chaleur. L’aérogel en lui-même peut être produit à partir de plusieurs matériaux, mais généralement il s’agit d’un composé formé de silice et de carbone.
Enfin, pour l’anecdote, sa couleur bleutée n’est pas la couleur du matériau, mais le fruit de la diffraction de Rayleigh de la lumière : il s’agit du même mécanisme optique qui donne naissance à la couleur bleue du ciel.
La lumière incidente blanche se voit décomposée : les grandes longueurs d’onde, comme le rouge, le jaune, conservent leur trajectoire rectiligne et ne sont que peu déviées, tandis que les courtes longueurs d’onde, comme le bleu, sont diffusées partout dans la structure : l’ensemble du bloc d’aérogel luit alors d’un reflet bleuté caractéristique.
Le micro-lattice

Dans le même style que l’aérogel, c’est à dire très léger, poreux et isolant, citons le micro-lattice, présenté par Boeing.
Il s’agit d’un matériaux structuré en nano-tubes de nickel. Imaginez pour cela une structure semblable à la tour Eiffel (très aérée et rigide) mais microscopique : chaque « branche » de forme tubulaire ne mesure que quelques centaines de microns de diamètre pour une épaisseur d’une centaine de nanomètres seulement.
Sa structure tubulaire fait qu’il est composé essentiellement d’air, et il est pour cela extrêmement léger, à tel point que ça en fait le matériau solide le plus léger qui existe. Il est environ 100 fois moins dense que le polystyrène et à peine 1,7 fois la densité de l’air !
Cette légèreté va de paire avec des propriétés élastiques relativement intéressantes. À la manière du polystyrène ou d’un tapis de mousse, on peut le déformer et il reprendra sa forme. Il est envisagé de l’utiliser par exemple dans les amortisseurs ou des dispositifs d’absorption de chocs.
Le Vantablack

Plus un revêtement qu’un matériau, le vantablack est tout simplement la matériau le plus noir qui soit.
Si un tableau noir vous semble sombre, il renvoi tout de même environ 30% de la lumière. Une surface noircie à la fumée et à la suie renvoie environ 5 % de lumière (ce qui est déjà très sombre). Le vantablack, lui, ne renvoi que 0,035 % de la lumière.
Il est tellement sombre qu’un objet recouvert de vantablack a des aspects surréalistes : il semble comme « photoshopé », et toutes les aspérités ou reliefs de l’objets en deviennent indétectables à l’œil.
Cet effet est obtenu par une forêt de nano-tubes de carbones alignées verticalement. Le nom « vanta » signifie d’ailleurs « vertically aligned nanotube arrays », soit « ensemble de nanotubes alignés verticalement ». Le produire est relativement difficile et il s’agit de se laisser déposer des atomes de carbones à l’état de gaz sur une surface chauffée à une température bien précise.
Le fonctionnement est relativement simple : les nanotubes de carbones piègent les photons qui viennent le heurter et les absorbent pour les dissiper sous forme de chaleur. La particularité de ce revêtement est que son absorbance est relativement universel : tous les photons sont piégés : aussi bien la lumière visible que la lumière de plus haute énergie que ceux de plus basse énergie.
Ses applications sont spécifiques mais intéressantes.
En particulier, il pourrait être utilisé dans les endroits où il s’agit d’éviter les reflets de lumière, comme les faces internes des télescopes astronomiques.
Le vantablack, par sa surface recouverte de nanotubes est également super-hydrophobe : l’eau ne colle pas du tout dessus et est même repoussée. Un revêtement au vantablack voit l’eau ruisseler dessus et ne mouille pas du tout.
Nitinol, ALON, µ-Metal
Enfin, pour terminer cet article, quelques matériaux métalliques impressionnants.
Le Nitonol
Le nitinol (pour Nickel-Titanium Naval Ordnance Laboratory) est alliage de nickel et de titane qui a la particularité d’être un métal à mémoire de forme relativement puissant. Le métal se présente sous la forme d’un fil et on peut le tordre dans tous les sens. Placez-le ensuite dans un verre d’eau chaude et il reprend sa forme rectiligne. S’il était initialement sous une autre forme (ressort, trombone, un cœur…), il suffit de le déformer puis de le plonger dans l’eau chaude pour qu’il redevienne comme avant !
On lui donne la forme naturelle tout en le chauffant au rouge, au dessus de sa température de cristallisation. Une fois refroidit, le déformer provoque des tensions entre les liaisons nickel-titane. C’est en chauffant avec de l’eau chaude (40~50 °C) que ces tensions retendent le métal pour qu’il reprenne sa forme. Dr Nozman en a fait une vidéo ici.
Ce métal est utilisé non pas trop pour faire des formes, mais plutôt pour sa tension : refroidit, on peu aussi l’allonger. Quand on le chauffe, il se contracte comme un élastique, et sa force de traction est d’une remarquable puissance.
On trouve des échantillons de Nitinol de divers diamètres ou diverses températures d’activation sur le net, par exemple eBay.
L’AlON
L’AlON, pour Aluminium oxy-nitride, est un matériau à base d’aluminium qui a la particularité d’être transparent. C’est donc comme une vitre, mais en aluminium ! Il est parfois appelé « aluminium transparent » en référence au matériau du même nom utilisé dans Star Trek.
L’AlON est transparent avec la robustesse de l’aluminium : il en fait naturellement un très bon candidat pour des vitres blindées dans différents domaines : militaire, civile, aérospatiale, etc. à la place du verre, qu’il remplace avec une épaisseur bien moins importante.
Le mu-métal et le permalloy
Ces matériaux, tous deux alliages de fer et de nickel, ont la particularité d’être des isolants magnétiques. Ce ne sont pas des cages de Faraday, qui eux sont des isolants pour les ondes électromagnétiques : un chapeau en aluminium vous protégera peut-être des ondes radio, mais pas d’un aimant ! Si vous voulez une isolation magnétique, il faut un chapeau en mu-métal ou en permalloy.
En théorie, si on place une boussole sur une surface de permalloy, un aimant qui passe en dessous ne la déviera pas : le champ magnétique de ce dernier est totalement dévié et emprisonné dans la plaque. Réciproquement, une boussole placée dans une cage en permalloy ne captera pas le champ magnétique terrestre et pointera où elle veut.
En pratique, un isolant magnétique parfait n’existe pas, mais le µ-métal et le permalloy sont de très bon isolants. Ils sont utilisés sous la forme de films pour blinder les câbles internet sous-marins (protégeant le câble des influences extérieurs, mais aussi l’environnement et la faune des influences du câble) ou pour protéger des dispositifs électroniques sensibles en tout genre. Certains bâtiments (par exemple des bâtiments de recherche) comportent un blindage magnétique obtenus avec ces matériaux.
Pour info, le nom de ces matériaux, quoi que commercial, n’est pas choisi au hasard :
- le mu-métal (ou µ-métal) : « µ » (la lettre grecque « mu ») désigne la perméabilité magnétique d’un matériau. Le mu-métal porte son nom en référence à sa grande perméabilité magnétique.
- le permalloy : idem, le « perm » vient du mot « [magnetic] permeability » ; alloy désignant alliage en anglais.
Là aussi, comme pour l’aerogel ou le nitinol, on peut en trouver en ligne, pour divers usages que vous pourriez avoir.