
Les lumières LED (ou DEL, en français) nous envahissent : bien moins gourmandes en énergie, moins chauffantes et plus colorées, elles ont pas mal d’avantages. Mais comment ça marche ?
Comment produit-on de la lumière sans LED ?
De façon ancestrale, on a toujours produit de la lumière avec du feu (torche, chandelle, bougie…) et plus généralement avec de la chaleur (lumière solaire, lampe à filament).
Ces dispositifs fonctionnent avec le principe de la loi du rayonnement de Wien : tout objet chauffé émet du rayonnement. Le corps humain à 37 °C émet dans l’infrarouge. Une flamme à ~1 000 °C émet dans le rouge-orangé. Un filament de tungstène dans une lampe à incandescence traversée par un courant chauffe à 3 000 °C et émet de la lumière blanche.
Le principal ennui avec une lampe à incandescence, c’est que la majeure partie de l’énergie est perdue en chaleur.
Et avec la LED ?
Avec les LED, c’est différent. Le rayonnement émis n’est plus produite par la température mais par un tout autre phénomène, qui n’implique pas de monter en température comme un filament. On passe ainsi d’un rendement lumineux de 5 % pour les lampes classiques à un rendement proche des ~50 %, ce qui est nettement mieux.
Le fonctionnement relève de la physique quantique des semi-conducteurs. Les semi-conducteurs, comme le silicium ou le gallium, sont des matériaux à mi-chemin entre les conducteurs (métaux) et les isolants (plastiques ou verre, par exemple) :

Tous les éléments ont des couches d’électrons autour du noyau. Certaines couches sont responsables des liaisons atomiques dans les molécules : ces couches sont dites « de valence ». La couche externe, est celle qui comporte des électrons libres, ces électrons qui, dans un métal, peuvent conduire du courant électrique. Cette couche est donc dite « de conduction ».
Dans un conducteur électrique, la couche de conduction n’est pas vide et il contient des électrons. Dans un isolant, il n’y a pas d’électrons libres. Sur le schéma ci-dessus, voyez-le comme des niveaux de remplissage : le niveau de Fermi constitue le remplissage d’un atome. Dans un conducteur, le remplissage suffit pour que certains électrons soient conducteurs.
Pour qu’on puisse rendre un matériau conducteur, on peut aussi forcer certains électrons à passer du la bande de valence à la bande de conduction. Pour ça, on donne de l’énergie à l’électron et il passe dans la bande de valence. On fait ça en lui appliquant une tension électrique.
Dans un semi-conducteur, l’application d’une tension faible suffit à faire passer des électrons de la bande de valence à la bande de conduction, et donc de la rendre conductrice. Dans un isolant, il faut une tension très importante, bien au-dessus des limites usuelles (220 V ne suffisent pas, par exemple, pour rendre le caoutchouc conducteur, c’est pour ça que c’est un isolant très pratique).
Une DEL est avant tout une diode
Les semi-conducteurs sont un vaste sujet, et j’ai un article dédié à ça que je vous invite à lire : C’est quoi un semi-conducteur ? Ici je vais résumer un peu.
Le silicium est le plus connu des semi-conducteurs, et aussi le plus utilisé actuellement. En l’état, il ne permet pas grand-chose, car tous les électrons sont covalents et il n’y a pas d’électrons de conduction. Pour combler ce manque, on va ajouter du phosphore dans le silicium.
Le phosphore a un électron en plus que le silicium : quand du phosphore se trouve dans le silicium, il y a donc un électron libre en trop. Ceci ajoute donc une charge libre dans le silicium. Une autre solution est d’ajouter du bore : celui a un électron en moins, et donc un « trou ». Ce trou, en étant bouché, peut également se déplacer : il est également considéré comme porteur de charge (positif). On se retrouve avec deux types de semi-conducteurs : N et P respectivement :
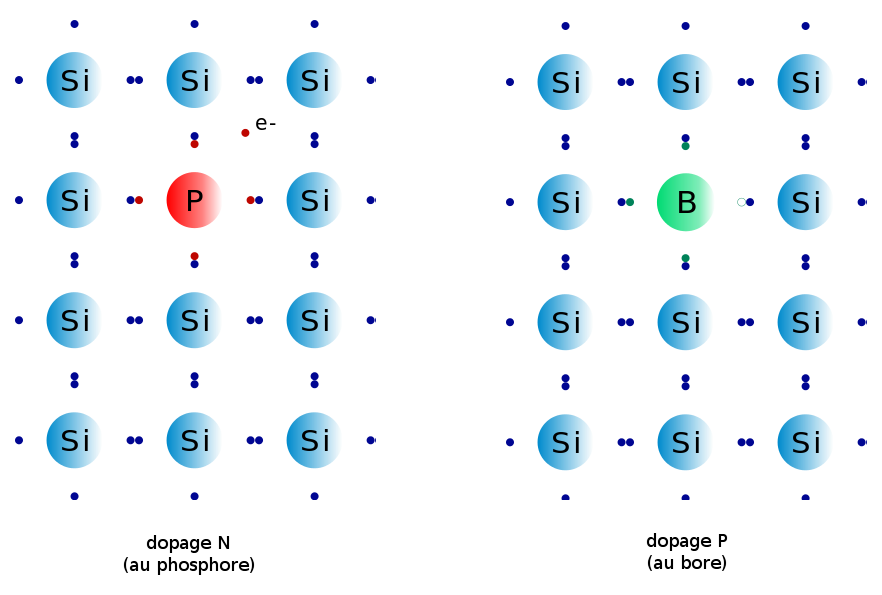
Une diode c’est une juxtaposition de deux (di-ode) semi-conducteurs, un P et un N. Or, quand on juxtapose ces deux éléments, il se produit un phénomène naturel intéressant. Au niveau de la jonction, les électrons en trop du phosphore vont aller boucher les trous du bore. Cette migration d’électrons va produire des régions électriquement chargées au sein du composant :

Les régions chargées au centre vont être responsables de l’apparition d’un champ électrique au niveau de la jonction. De plus, les électrons ayant bouché les trous, il n’y a plus de porteurs de charges à cet endroit et le semi-conducteur n’est plus conducteur. Cette région à la jonction P-N porte le nom de zone de déplétion : les atomes y sont ionisés (et la région est chargée à cause des électrons et des trous en trop), mais électriquement isolante car ces charges sont fixes (non mobiles). C’est la zone de déplétion qui va rendre possible l’effet « diode »,
Si l’on met ce dipôle sous tension, avec le + à la zone P et le – sur la zone N, alors les électrons arrivant sur la zone N (à gauche sur le schéma) vont y remplir les trous, tandis que sur la zone P (à droite), les électrons en trop vont être aspirés par le pôle + de la pile : la zone de déplétion se réduit alors.
Sous réserve de l’application d’une tension suffisante, appelée la tension de seuil, les électrons pourront sauter de la région N à la zone P, rendant le dipôle conducteur : le courant de la pile passe.
Si l’on change le sens du branchement, alors les électrons vont être injectés sur la zone P (qui a déjà un surplus) et aspirés à gauche (formant encore plus de trous). La zone de déplétion est donc élargie, et cette zone isolante bloque d’autant plus le passage du courant : la diode est bloquante. Elle le restera tant que la tension appliquée ne dépasse pas une tension de claquage : une tension si important qu’elle forcera les électrons à sauter d’une région à l’autre (mais ceci aura pour effet de « griller » le composant et de la détruire).
Passant dans un sens, bloquant dans l’autre : c’est là bien le principe d’une diode.
Les diodes sont un composant très simple fait de deux semi-conducteurs N et P joints ensemble, mais cette simplicité n’enlève rien à la révolution électronique que leur invention ont permit.
Et la lumière de la LED dans tout ça ?
Pour l’instant, on a vu la diode, mais il n’y a pas encore de lumière. Une LED, ou DEL en français, c’est une diode électroluminescence : c’est donc une diode qui émet de la lumière.
La lumière est obtenue au niveau de la jonction, au moment précis où un électron rebouche un trou : on parle d’une recombinaison « électron-trou ».
En effet, un électron qui bouche un trou, c’est un électron qui passe de la bande de conduction à la bande de valence, autrement dit passe d’un état d’énergie élevée à un état d’énergie faible. Lors de la recombinaison, les électrons perdent donc une certaine quantité d’énergie, qui est alors émise sous la forme d’un photon. Si ce photon est dans le domaine du visible, la diode émet de la lumière visible.
La lumière des LED vient donc de la stabilisation du semi-conducteur par la recombinaison électron-trou.
Ce qu’il y a d’intéressant ici, c’est que selon le matériau semi-conducteur choisi, le gap d’énergie (c’est à dire la différence d’énergie issue de la recombinaison) est très précise et sera aussi celle du photon. Dit autrement, selon le matériau choisi, on peut choisir la couleur de la lumière que l’on souhaite !
Dans le silicium, la lumière émise est infrarouge et on ne peut pas la voir. Pour faire des LED de lumière rouge ou vert, il faut d’autres matériaux : arséniure et phosphure de gallium, arséniure d’indium, etc.
Les diodes émettant du blanc n’existent pas : leur technologie repose sur la combinaison de plusieurs sous-diodes dont la lumière une fois mélangée apparaît comme du blanc.
Pour l’anecdote, les LED rouges ont été les premières à être conçues. Dans les années 1990, elles sont apparues partout. Les LED blues efficaces et utilisables ont en revanche demandé des années de recherche pour être mises au point. À tel point que leur invention dans le milieu des années 1990 et a été récompensée par un prix Nobel. Ce n’est que dix années après, après 2005, qu’on commence à les trouver autant que les LED rouge ou vertes (également apparues entre temps).
Résumé
Les LED sont des diodes particulières : des diodes où la recombinaison électron-trou émet un photon visible.
L’ensemble est possible grâce aux semi-conducteurs, et au dopage : ajout ou retrait d’un électron grâce à l’incorporation de phosphore ou de bore dans le silicium.