
Dans la série « il y a une raison à tout », peut-être désirez-vous savoir d’où vient le 1,5 V des piles alcalines ou saline ?
Bien-sûr, on trouve également des piles plates de 4,5 V, ou des piles de 6 V, et même de 9 et 12 V. Mais si vous avez déjà ouvert une telle pile, vous savez qu’elles contiennent 3, 4, 6, et 8 unités de 1,5 V chacune respectivement.
Il y a évidemment une raison à ce 1,5 V et elle réside dans la nature même d’une pile, qui est un dispositif chimique.
L’oxydo-réduction
Dans une molécule, les atomes s’organisent en partageant leurs électrons. Quand deux molécules réagissent entre elles, elles peuvent s’échanger des électrons : une telle réaction, où ce qui est échangé sont des électrons, est appelé une réaction d’oxydo-réduction. Un des composé (le réducteur) se transforme et libère un électron, et un autre, l’oxydant, le capte pour se transformer également.
Le truc ingénieux dans une pile électrique, c’est que le réducteur et l’oxydant ne sont pas directement en contact. Ils sont séparés par une barrière imperméable aux électrons. La seule façon pour qu’un électron passe du réducteur vers l’oxydant, c’est en passant par un fil électrique : c’est notre circuit électrique !
Une pile seule, c’est donc deux produits chimiques qui ne peuvent pas se mélanger.
Quand on relie les deux bornes de la pile par un fil, les électrons quittent le réducteur par la borne négative pour aller réduire le produit oxydant qui se trouve derrière la borne positive.
La réaction chimique ne peut donc se produire que lorsqu’on branche la pile dans un circuit. Par suite, tant que la réaction a lieu, le courant circulera. Ce n’est que lorsque tous les réactifs sont consommés que la réaction s’arrête et que le courant cesse de circuler : la pile est alors vide.
La composition d’une pile électrique
On l’a vu au dessus : dans une pile, il y a deux ensembles : l’anode, qui veut donner des électrons, et la cathode qui veut les capter. On parle même de « demi-piles » :
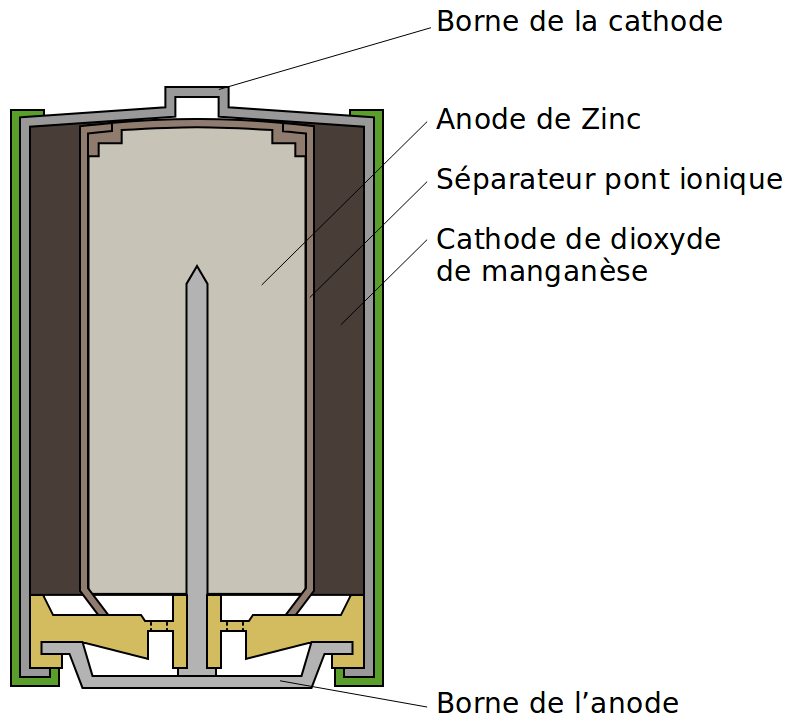
Si l’on prend l’exemple des piles alcalines, l’anode contient du zinc en milieu basique, qui libère des électrons en devenant de l’oxyde de zinc :
$$Zn_{(s)} + 2OH^{-}_{(aq)} \longrightarrow ZnO_{(s)} + H{2}O_{(l)} + 2e^{-}$$
De l’autre côté, à la cathode, les électrons arrivent sur du dioxyde de manganèse baignant dans de l’ammoniaque et l’ensemble va former du sesquioxyde de manganèse :
$$2MnO_{2, (s)} + H_{2}O_{(l)} + 2e^{-} \longrightarrow Mn_2O_{3, (s)} + 2OH^{-}_{(aq)}$$
Or, comme dans les faits les deux demi-piles ne peuvent fonctionner l’une sans l’autre, on peut écrire ces deux équations de demi-piles en une seule équation totale de la pile :
$$Zn_{(s)} + 2MnO_{2, (s)} \longrightarrow Mn_2O_{3, (s)} + ZnO_{(s)}$$
Dans un circuit électrique, ce qui fait la nature même de l’électricité, c’est la circulation des électrons.
Cette dernière équation se produit par un transfert d’électrons d’un réactif à un autre, et ces électrons empruntent le chemin du circuit électrique.
Et ce fameux « 1,5 V » ?
Il y a deux caractéristiques principales notables pour un courant électrique :
- l’intensité : il s’agit du nombre d’électrons qui passent dans le circuit ;
- la tension : il s’agit de la « vivacité » des électrons, la force avec laquelle ils traversent le circuit.
Pour augmenter l’intensité, il suffit de mettre plusieurs piles en parallèle : le nombre d’électrons libérés par les réactions dans chacune des piles va alors automatiquement augmenter.
Pour la tension, il faut savoir que quand un atome ou une molécule libère un électron, il le fait avec plus ou moins de facilité. C’est ici qu’intervient la notion de potentiel électrique : ici, c’est le potentiel qu’a une molécule pour libérer un électron.
La tension électrique dans un circuit correspond à la différence de potentiel électrique entre les extrémités du circuit. Ici, plus l’anode pousse les électrons dans le circuit, plus son potentiel est négatif et plus la cathode arrive à les consommer, plus son potentiel est positif. La différence de potentiel entre l’anode et la cathode correspond à la tension nominale de la pile.
Les potentiels de chaque demi-pile sont dictées par les réactifs eux-mêmes. Chaque couple oxydant-réducteur a un potentiel chimique bien précis.
Ainsi, dans le cas de la pile alcaline zinc-dioxyde de manganèse, on a :
- à l’anode : ${Zn}/{ZnO}$ : −1,28 V
- à la cathode : ${MnO_2}/{Mn_2O_{3, (s)}}$ : +0,15 V
La différence entre les deux est de 1,43 V, ce qui correspond bien environ aux 1,5 V des piles alcalines standard.
Et les autres piles et batteries ?
Dans les autres piles, on a la même chose : deux demi-piles, avec deux réactions : une qui libère un électron et une autre qui la consomme.
Dans la pile saline, qui est similaire à une pile alcaline, c’est juste que le zinc et le dioxyde de manganèse baignent dans une solution acide. Plusieurs réactions ont lieu sur le manganèse, mais la tension totale de la pile est là également sensiblement de 1,5 V.
Les accumulateurs Ni-Cd ou NiMH ont quant à elles une tension nominale de ~1,2 V, à cause des potentiels de réduction valant −0,49 pour l’anode et +0,80 sur la cathode.
Dans tous les cas précédents, les potentiels sont très proches les un des autres et ceci est plutôt pratique : un appareil conçu pour des piles alcalines fonctionneront aussi (sauf exceptions) avec des accumulateurs NiMH malgré une faible diminution de tension.
Dans les batteries Li-ion et Li-Po, la tension nominale est de 3,7 V : le fonctionnement est le même, mais les différences de potentiel entre les deux demi-piles est alors bien plus important ici.
Dans les piles 4,5 V et les autres, on trouve une suite de plusieurs piles de 1,5 V branchées en série : les potentiels de chaque pile s’additionnent en cascade et l’on obtient 4,5 V pour 3 piles, ou 9 V quand on a 6 piles, etc.