
On peut avoir tendance à confondre les termes de fluorescence et phosphorescence, pourtant ce sont deux choses différentes, à la fois au niveau fondamental et par leur manifestation durant la vie de tous les jours.
Les deux phénomènes sont liées à l’émission de lumière dite « froide ».
Commençons par définir la lumière : c’est une onde, donc une propagation d’énergie. Ensuite la matière : elle est composée d’atomes eux-mêmes fait d’un noyau et d’électrons.
Quand de la lumière ou une autre forme d’énergie arrive sur un électron de la matière, ce dernier peut capter son énergie. L’électron possède dès lors un surplus d’énergie par rapport à son niveau au repos : il est dit « excité ». L’électron se désexcite en libérant cette énergie sous une forme ou une autre : électricité, chaleur, potentiel chimique ou… de la lumière !
La fluorescence et la phosphorescence font partie des cas où l’électron se désexcite en émettant de la lumière, mais leur méthode d’action est différente, et la manifestation de cette émission de lumière également.
Modèle quantique de l’atome
Avant de commencer, il faut voir un peu comment on modélise l’atome aujourd’hui, et plus précisément les niveaux électroniques.
Les atomes sont des noyaux autour duquel figurent des électrons. Ces derniers existent dans des états énergétiques bien précis. On dit que les électrons on des niveaux d’énergie. Quand on chauffe ou illumine la matière, les électrons changent de niveau : ils s’excitent.
Voyez ça comme immeuble avec des étages et un ballon : par défaut, le ballon est en bas au niveau du sol. Le ballon peut être placé sur les différents étages, lui conférant de l’énergie. Plus le ballon est haut, plus il a de l’énergie. Inversement, le ballon peut descendre. Et plus il descend de haut, plus il peut faire de dégâts en tombant.
On constate que le ballon peut se trouver sur l’étage 1, ou 2, ou 3, etc. mais pas au milieu. Il n’y a pas d’étage 2,5. On dit que les niveaux d’énergie sont discontinus, ou quantifiés. Dans le cas de l’électron c’est exactement la même chose.
Maintenant, les molécules : ce sont des assemblages d’atomes. Ici, on a toujours des niveaux d’énergie électronique principaux (nos « étages ») mais il y a en a d’autres : il y a aussi des niveaux d’énergie lié à la vibration de la molécule, également quantifiés. Pour notre ballon, on peut les voir comme les marches de l’escalier entre chaque étage.
Ainsi, on peut placer le ballon au milieu de l’escalier : la ballon aura toujours l’énergie du premier étage, mais il en aura également « un peu plus » à cause de l’escalier.
Notons toutefois que chaque étage est sub-divisé par des marches d’escaliers.
L’analogie avec les électrons s’arrête ici. En effet, typiquement, les énergies des niveaux électroniques se font (généralement) par émission de lumière. Alors que les changements liés à la vibration ou la rotation des molécules se font (généralement) par émission de chaleur. Tous les changements ne produisent donc pas de la lumière.
C’est important pour la suite.
En terme de schéma, on peut le présenter ainsi :

Plus deux niveaux d’énergie sont éloignés, peu importe lesquels, plus la différence d’énergie est grande.
La fluorescence
Il s’agit de l’émission rapide de lumière après une absorption d’énergie.
Dans le cas de la fluorescence, l’excitation est telle que l’électron change de niveau électronique. Il passe donc d’une sous-couche d’un niveau 1 à une sous-couche d’un niveau 2.
Ce n’est pas quelque chose de systématique. Par exemple, si l’on excitait la matière de façon plus douce, alors l’électron peut passer d’une sous-couche du niveau 1 à une autre sous-couche du même niveau 1. La distance entre les deux niveaux est alors plus faible, et l’énergie également.
Mais pour qu’il y ait fluorescence, il doit y avoir changement de niveau électronique. Par exemple :

Dans la phase « 1 » ici, l’électron absorbe de l’énergie incidente, par exemple de la lumière.
L’électron ne va cependant pas rester comme ça. Généralement, il va se désexciter. Le plus souvent, il va commencer à descendre les niveaux d’énergie de vibration et de rotation du niveau excité « 2 » par une émission de chaleur (émission non radiative), puis va descendre au niveau électronique de base « 1 » par une émission de lumière (émission radiative), puis va retourner dans l’état fondamental du niveau électronique de base, tout en bas, à nouveau par une émission de chaleur (non radiative) :
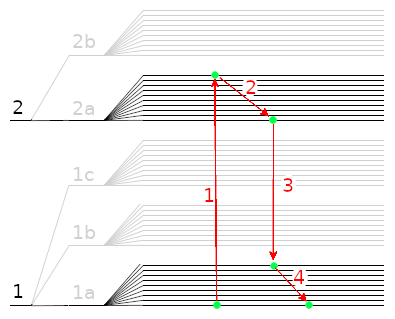
On peut noter plusieurs choses ici. Déjà, ce phénomène est instantané : aussitôt qu’un électron capte de l’énergie, il la ré-émet. Quand je dis « instantanée », on parle d’une durée de l’ordre de la nanoseconde. La fluorescence est une émission lumineuse rapide suite à une absorption d’énergie par un électron avec changement de niveau électronique.
Ensuite, on note que la flèche d’émission « 3 » est plus courte que la flèche d’absorption « 1 ». Cela signifie que l’énergie de la lumière émise est plus faible que l’énergie de la lumière absorbée. Par exemple, dans le cas de la fluorescence de la chlorophylle par la lumière, la lumière absorbée sont des UV énergétique, et la lumière émise est verte ou rouge, moins énergique que la lumière UV qui provoque la fluorescence.
La différence d’énergie entre 1 et 3 est émise lors des phases 2 et 4 sous forme de vibration thermiques.
La fluorescence est le phénomène responsable des couleurs dites « couleurs fluo » : les pigments réagissent à la lumière UV et produise des couleurs de plus faible énergie : jaune, verte, etc.
C’est aussi la fluorescence qui fait briller un t-shirt blanc sous la lumière noire ou sont à la base du fonctionnement des tubes « néon » : ici c’est l’électricité qui excite le gaz dans le tube, qui va à son tour émettre de la lumière.
La phosphorescence
Si la fluorescence est rapide, la phosphorescence est lente : les objets qui continuent de briller dans le noir après qu’on a éteint la lumière fonctionnent par phosphorescence.
La différence se situe au niveau de la désexcitation : l’étape d’absorption d’énergie est la même, mais la restitution se fait en passant par un état intermédiaire, dit « état triplet ».
Pour comprendre ça, il faut voir que les électrons sont des systèmes assez complexes que l’on décrit avec des nombres quantiques, au nombre de quatre. Sans aller dans les détails (je vous renvoie pour ça à mon article sur les orbitales atomiques), il faut surtout retenir ici que deux électrons ne peuvent pas avoir quatre même nombres quantiques. Si trois nombres sont identiques pour deux électrons, alors le quatrième sera forcément différent.
Maintenant, les électrons se regroupent préférentiellement en paires (notamment pour former des liaisons moléculaires). Chaque niveaux d’énergie dans les schémas ci-dessus contiennent donc deux électrons. Ces deux électrons sont sur le même niveau d’énergie (même couche, même sous-couche et même orbitale), la seule différence entre les deux électrons est alors le spin : les deux électrons ont des spin opposés, ces derniers sont sont notés ↑ et ↓ (up et down).
Ceci est dans le cas d’un état normal, aussi appelé « état singulet ». Tous les électrons y sont en paires et il n’y a pas d’électron « célibataire ».
Dans un état excité, comme c’est dans le cas de la phosphorescence, une paire peut se séparer, et on se retrouve avec deux électrons célibataires de même spin. Comme ils ont alors des spin identiques, c’est un autre des nombres quantique qui doit changer (ils ne peuvent pas être tous identiques). Un des deux électrons va donc passer à un niveau d’énergie triplet, sur une autre orbitale mais avec une énergie identique (donc sans émission de lumière). Cette phase où un électron préfère changer d’orbitale plutôt que de spin est appelée une transition intersystèmes.
L’électron va ensuite descendre les sous-niveaux de l’état triplet avant de redescendre au niveau électronique de base. Sauf que les transitions dans cet état triplet sont plus difficiles à produire et la réaction est beaucoup plus lente : au lieu de prendre des nanosecondes, elle prend des valeurs allant de la milliseconde à plusieurs heures.
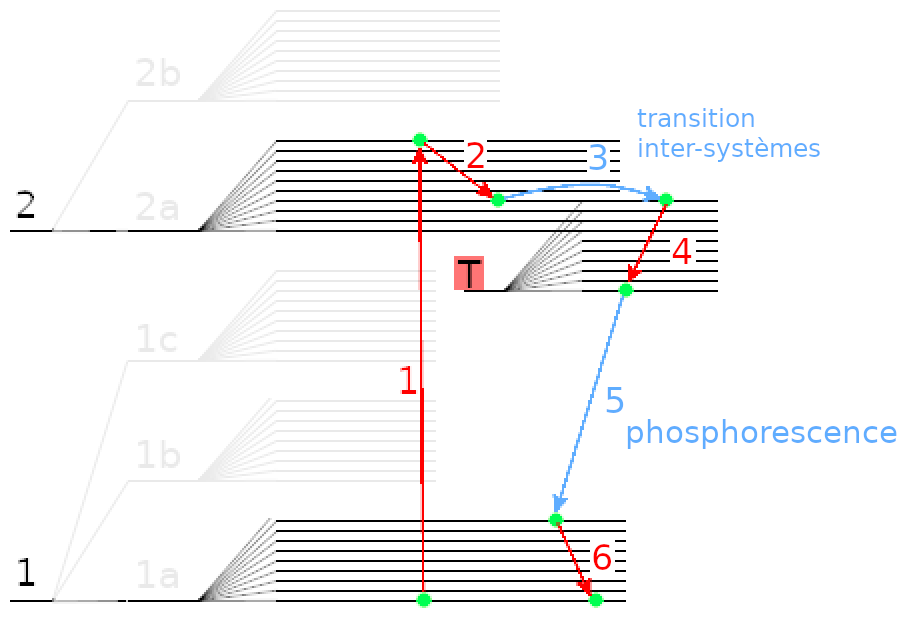
Vu que le processus total prend du temps, parfois plusieurs heures, les objets phosphorescents peuvent briller dans le noir même après avoir éteint la lumière.
C’est le cas des aiguilles de certaines montres ou des peluches « Luminou » qui brillent dans le noir. Les cristaux dans la photo d’en-tête sont un exemple de phosphorescence aussi.
Exemples non-phosphorescents
À noter que certains vieux objets comme des vieilles montres du début du XXᵉ siècle avec les aiguilles phosphorescentes utilisaient comme source d’énergie non pas une exposition à la lumière, mais la désintégration radioactive du radium. Ces objets ne sont plus fabriqués aujourd’hui et il est recommandé de ne pas les porter sur soi : le radium étant radioactif et très dangereux.
Les petits bâtons lumineux « snap-light » qu’il faut plier en deux, briser une fiole et qui émettent une lumière chimique durant 8 heures ne sont pas phosphorescents mais fluorescent. C’est juste que c’est l’énergie d’activation qui est libérée de façon progressive : une réaction chimique lente entre plusieurs composés dont la réaction est chimioluminescence.
Dernier exemple, les petits porte clés « Glow-Ring » au tritium ne sont pas phosphorescents non plus. Comme les montres radioactives, ces tubes utilisent également un composé radioactif pour exciter un produit fluorescent. La radioactivité étant permanente, le porte clé brille continuellement durant plusieurs dizaines d’années. Ils sont en polycarbonate et moins dangereux que les montres, mais restent radioactifs et interdits.
Conclusion
Retenez donc que la différence visible se fait sur la durée : la fluorescence est courte et la phosphorescence est longue.
Tout ça à cause de comportements quantiques des électrons et la façon — lente ou rapide — dont ils se débarrassent de leur excédant d’énergie.
La plupart des éléments phosphorescents que vous pouvez éventuellement avoir chez vous comportent du sulfure de zinc, qui est responsable de la phosphorescence. Dans la photo d’en-tête de l’article, on voit des pierres à base de terres rares (lanthane, europium, dysprosium…) et est le matériau le plus phosphorescent connu à ce jour. Une fois activé avec une lumière bleue ou UV, et bien que sa luminosité baisse de façon exponentielle (donc très rapidement au début), il luit durant toute une nuit sans problème ! Son nom commercial sur le site qui le vendait était « kryptonite ».
Liens vers d’autres articles
- Pourquoi certaines couleurs sont fluos ? ;
- Pourquoi les chaussettes blanches paraissent si lumineuses sous a lumière noire ? ;
- Les porte-clé Tritium Glowring et les tubes luminescents au tritium ;
- L’effet Vavilov-Cerenkov : ou flash superluminique ;
- La radioactivité dans les objets du quotidien.
(Cet article a initialement été publié sur Le Hollandais Volant en 2011. J’ai décidé de mettre à jour et de le déplacer ici)
Image d’en-tête : travail personnel.