
Dans la vie courante, vous avez sûrement déjà rencontré des petits sachets de dessicant en gel de silicates, aussi appelé silicate synthétique amorphe. On en trouve dans les boîtes de chaussures neuves ou les poches des vêtements dans les magasins, par exemple, mais ses applications vont bien au-delà de ça.
Ils servent à déshumidifier et éviter que l’humidité ambiante ne détruise la marchandise.
Comment ça marche ?
Ces billes de silicates (oxydes et hydroxydes de silicium) sont dures et ne prennent pas forcément de volume lorsqu’ils adsorbent l’humidité. Contrairement à une éponge, ils ne deviennent pas non plus humides au toucher. Leur principe « actif » peut donc sembler un peu mystérieux, surtout si l’on compare aux billes en polymère super-absorbants (« jelly-marble »), qui elles prennent jusqu’à 100 fois leur volume et qui sont humides au toucher.
Les billes en gel de silice sont des silicates, donc essentiellement une structure minérale en dioxyde de silicium. Il s’agit de la même composition chimique que le quartz ou le verre de la vie courante, voire tout simplement du sable. Ce qui change est essentiellement la disposition des molécules, plutôt que la composition.
La particularité du gel de silicate est qu’il est préparé de façon à avoir une structure nano-poreuse. La composition chimique est identique, c’est juste l’agencement mécanique qui diffère.
En l’occurrence, la structure de ce « gel » — qui est tout de même dur et non réellement gélatineux — se présente comme un amas de « globules » de dioxyde de silicium entre lesquels se situent des pores. C’est donc une structure aérée, peu dense. Ce sont ces pores qui adsorbent les molécules d’eau et piègent l’humidité :
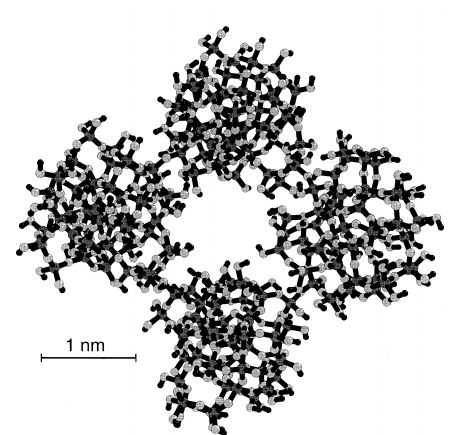
Notez bien que l’on parle ici d’adsorption — avec un D — et pas d’absorption, avec un B. La différence est importante.
L’adsorption est un phénomène de surface : les molécules adsorbées se fixent sur la surface de la matière adsorbante, éventuellement sous la forme de plusieurs couches successives, alors que pour l’absorption, le produit absorbé finit dans le volume de la structure absorbante et peut participer à sa cohésion.
Dans ces conditions, si l’on veut que l’eau soit adsorbée en grande quantité, il faut une surface importante. L’efficacité du dioxyde de silicium préparé sous forme de gel de silice en tant que dessicant réside dans sa très grande surface spécifique. C’est le rôle de ces globules et des pores : chaque globule présente une surface qui permet l’adsorption, là où une structure pleine ne présenterait aucune surface utile à l’intérieur.
Le gel de silice présente de cette façon une surface active de l’ordre de 750 à 800 m² par gramme !
On retrouve ce principe dans le charbon végétal (charbon actif) également, qui possède lui aussi une très grande surface spécifique sur lequel peuvent se fixer des impuretés diverses (raison pour laquelle on utilise le charbon végétal comme filtre pour capturer les odeurs et autres molécules étrangères).
Le gel de silice présente lui une grande affinité avec les molécules polaires, typiquement l’eau. Les molécules d’eau qui arrivent en contact avec la surface, finissent piégées par le gel et ne se retrouvent alors plus dans l’air, d’où ses propriétés dessicants.
Que se passe-t-il si l’on mange ces billes ?
En un mot : rien.
Bien que l’on mette ces billes dans des sachets où l’on indique « ne pas avaler » ou « do not eat », le gel de silice reste non toxique, non combustible et non dangereux : il ne s’agit que de sable capable d’adsorber un peu d’eau.
Leur pouvoir d’adsorption reste limité en fonction du volume de gel de silice, ce n’est donc pas non plus ça qui va vous déshydrater de l’intérieur.
Le produit est simplement mis dans un sachet « ne pas manger » car ce n’est pas pour autant comestible. Il s’agit aussi d’éviter toute confusion avec des sachets de condiments, sel ou poivre, que l’on peut trouver dans les restaurants par exemple.
Et les billes bleues ?
Il existe des billes de silices bleues, ou même roses, oranges. Ce sont des billes identiques mais dans lesquelles on a ajouté un colorant dont la couleur est visible quand la bille a adsorbé de l’eau. Dans ce cas, son pouvoir dessicant est terminé et il n’aide plus à assécher l’air. La présence du colorant aide alors à savoir si le dessicant doit être renouvelé ou réactivé.
Historiquement, on utilisait du chlorure de cobalt pour ça : les billes passaient alors de bleu (sec) à rose (hydraté). Il n’est plus utilisé aujourd’hui, car ce produit est toxique voire cancérigène.
Parmi les colorants utilisés aujourd’hui, on peut citer le sulfate d’ammonium et de fer, qui est orange quand il est sec mais incolore ou blanc lorsqu’il est hydraté.
Lorsque l’on détecte que le dessicant est hydraté, il convient alors de le réactiver par un passage dans un four par exemple, pour faire sortir l’humidité et les rendre dessicant de nouveau.
Le gel de silice seul (sans colorant) est non toxique, non réactif et sous sa forme de petites billes ne constitue pas de réel danger. Les billes cassées peuvent cependant engendrer des poussières irritantes.