
Le fer et l’acier sont ferromagnétiques : ils sont attirés par un aimant. Certains aciers, notamment une partie des aciers inoxydables par contre, ne le sont pas et cela peut surprendre. Voyons pourquoi, et en détails.
Un inox ?
Le fer et l’acier (non-inox) sont sensibles à l’action de l’oxygène, de l’eau, des acides… Le fer contenu dans l’acier s’oxyde et perd alors toute cohésion avec le reste du métal : l’ensemble s’effrite, expose alors des zones propres, qui vont alors s’oxyder à leur tour, s’effriter et ainsi de suite. Laissé au temps et aux éléments, l’acier normal finit totalement effrité et rouillé, perdant toute intégrité structurelle.
Ce que l’on appelle « inox » est le diminutif de « acier inoxydable ». Il s’agit d’un alliage d’acier — lui-même déjà un alliage de fer et de carbone — dans lequel on a incorporé quelques autres éléments, dont celui qui le rend résistant à l’oxydation : le chrome, à raison d’au moins 10,5 % de chrome, mais pouvant monter jusqu’à 30 %. Le chrome a une affinité plus importante que le fer avec l’oxygène, et il va s’oxyder en premier, en particulier le chrome en surface :
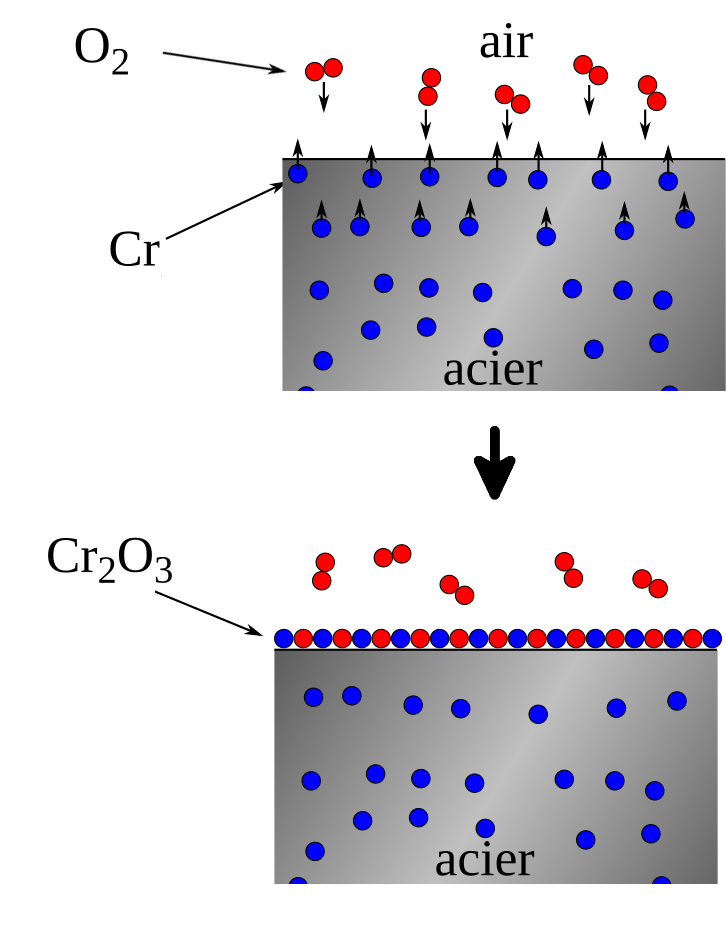
L’acier inox va très rapidement se recouvrir d’une couche d’oxyde de chrome. Contrairement à l’oxyde de fer cependant, l’oxyde de chrome est au contraire très résistant et va ainsi protéger le reste de l’acier, à la fois contre un effritement et contre toute rouille.
D’autres métaux ou alliages font sensiblement la même chose : aluminium, titane, argent, laiton, bronze… Ces métaux sont aussi sensibles à l’oxygène, mais leur surface est rapidement oxydée et protégée par cet oxyde. Ce phénomène, qu’il soit naturel ou provoqué de façon volontaire par un traitement de surface s’appelle la passivation.
L’acier « inox » est un terme générique qui désigne une large gamme d’alliages à base acier et chrome. La plupart du temps, on y ajoute également du nickel (autour de 10 %, mais parfois jusqu’à 35 %) pour le rendre plus solide. Pour la recherche de propriétés mécaniques, chimiques, de biocompatibilités plus fines, on peut y inclure également du titane, du molybdène, du tungstène, du vanadium… en quantité bien plus faible.
Voilà pour la présentation. Maintenant, pourquoi certains inox sont magnétiques et d’autres non ?
Une question de structure cristalline
Au sein d’un matériau sous sa forme solide, les atomes sont le plus souvent organisés en motifs répétables : on parle alors d’un réseau cristallin. Certains matériaux peuvent se présenter sous plusieurs formes différentes, dépendant notamment des conditions présentes à sa formation : température, vitesse de refroidissement, pression, chimie du milieu…
C’est le cas du carbone, pour prendre un exemple bien connu. Si le motif cristallin est hexagonal plat, cela forme un empilement de feuillets appelés graphène et on obtient du graphite, le même que celui des mines de crayons. Si le motif est cubique, on obtient du diamant[1]. On dit que le diamant et le graphite sont deux allotropes du carbone (et il en existe d’autres). On constate déjà que différents allotropes ont des propriétés très différentes.
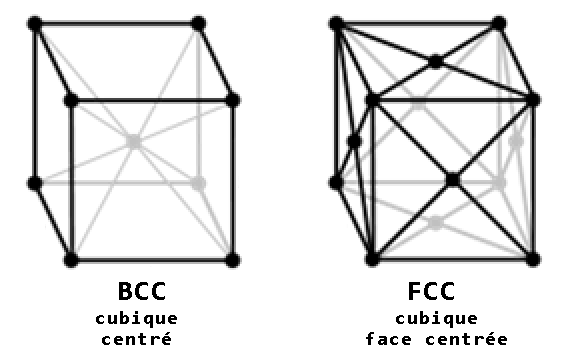
Le fer présente lui aussi un certain nombre d’allotropes, la plupart dépendant de la température. Ainsi, à température ambiante et jusqu’à 774 °C, le fer est dans sa forme fer-α (« fer alpha »), aussi appelé ferrite, qui est une configuration cristalline de type cubique-centré (body centred cubic, BCC).
Cela correspond à un maillage cristallin en forme de cubes avec un atome supplémentaire au centre du cube.
Entre 910 °C et 1 394 °C, les atomes se réorganisent et forment du fer-γ (« fer gamma »), appelé austénite. Il s’agit ici d’une configuration cubique face centrée (face centered cubic, FCC). La maille de base est toujours cubique, mais ici c’est chaque face du cube qui présente un atome en plus (et rien au centre).
L’une ou l’autre de ces configurations prennent forme à cause de la recherche d’une stabilité du fer, notamment par le changement du moment magnétique de spin (ou simplement « spin ») des électrons non appairés des atomes de fer.
À son tour, le spin va déterminer la proximité des atomes entre eux, et par suite la structure cristalline du matériau dans son ensemble.
Vous l’aurez compris : différents types d’alliages d’aciers inoxydables ont des configurations électroniques différentes, ce qui produit des structures cristallines différentes aussi, et donc également différentes propriétés magnétiques.
À savoir que pour l’acier, la structure BCC est ferromagnétique, et la structure FCC est paramagnétique.
Différences entre le fer-α et le fer-γ
Dans le ferrite (fer-α, ferromagnétique, structure BCC), les électrons non-appairés des différents atomes de fer vont se stabiliser en adoptant des spins identiques.
Lors d’une excitation par un aimant, les moments magnétiques de tous les atomes s’alignent et le matériau est fortement attiré. Cet alignement est même rémanent : il subsiste après le retrait de l’aimant. C’est la raison pour laquelle certains tournevis, ou même une simple aiguille, restent aimantées après les avoir frottées à un aimant.
Dans l’austénite (fer-γ, paramagnétique, structure FCC) les atomes de fer sont plus proches les uns des autres que dans le ferrite. Les orbitales se recouvrent davantage et la stabilité s’atteint ici plutôt par un alignement antiparallèle des spins des électrons non-appairés.
Un champ magnétique extérieur a plus de mal à les orienter « de force », et l’attraction par un aimant est bien plus faible, voire inexistants. De plus, cette aimantation disparaît lorsque l’aimant disparaît
Et dans l’inox ?
L’inox est de l’acier avec un fort pourcentage de chrome et de nickel. Le chrome et le nickel sont, de façon intéressante, également ferromagnétiques, quoique bien moins que le fer. Toutefois, au sein d’un inox, le nickel en particulier pousse l’acier dans sa globalité à former une structure FCC, qui n’est pas ferromagnétique.
Le chrome quant à lui peut, dans certains cas, stabiliser la configuration austénitique de l’acier — qui est FCC — à température ambiante, le rendant non-ferromagnétique ; alors que normalement, l’acier austénitique chaud redevient férritique à température ambiante.
Dans l’ensemble, donc, grâce à la présence du nickel, et selon les traitements en présence du chrome, les alliages d’acier inoxydables peuvent ou non présenter un caractère ferromagnétique, et donc être attiré par un aimant.
Le choix d’un type d’alliage ou d’un traitement dépend des propriétés recherchées. Le magnétisme est alors un effet de bord, à moins que ce soit lui-même la propriété recherchée.
Note : l’acier peut se présenter également sous une autre forme courante appelée martensite : c’est ce que l’on obtient lors de la trempe de l’acier ou lors de certains traitements mécaniques (y compris à froid). Ici, le cristal BCC du fer est fortement perturbé par la présence d’atomes de carbone isolés par un refroidissement brusque, au point de se réorienter la structure cubique centrée en une structure tétraédrique centrée (BCT). C’est la conséquence d’un refroidissement brutal (la trempe), qui empêche la migration du carbone en « îlots ». Cette structure maintient les liaisons cristallines tendues, durcissant fortement le métal obtenu, mais la rendant également plus cassant. La martensite est généralement ferromagnétique aussi.
Conclusion
Si l’on entend parfois que l’inox n’est pas magnétique, ce n’est donc que partiellement vrai. Certains inox ne sont effectivement pas attirés par des aimants, mais d’autres le sont bel et bien. En cause la phase cristalline. Cette phase peut être déterminée par la composition, le traitement thermique ou mécanique subi (certaines étapes de mise en forme par forgeage modifient la structure cristalline).
Si je résume dans un tableau :
| Type d’acier | Phase | Composition | Structure | Aimantable | Exemples |
|---|---|---|---|---|---|
| Ferrite | Fer-α | Fe, ou Fe, C | BCC | Oui | Fer et acier² à température ambiante |
| Austénites (incl. inox) | Fer-γ | Fe, C, Cr, Ni, Mn… | FCC | Non | Acier² entre 910 °C et 1 394 °C ; Inox 304, 316… |
| Martensites | Fer-α | Fe, C, Cr… | BCT | Oui | Aciers² et Inox trempés 410, 420, 440… |
À titre d’expérience à faire chez vous, vous pouvez vous promener dans la maison avec un aimant et tester les différents éléments en acier ou en inox se trouvant chez vous. Attention à ne pas confondre avec de l’aluminium, du nickel, du laiton, ou d’autres métaux.
Parmi les pièces en aciers inox qui ne réagiront pas, j’ai trouvé notamment chez moi :
- certaines poignées de portes ou fenêtres ;
- les parois ou couvercles des casseroles en inox (mais pas le fond, qui contient de la fonte) ;
- la robinetterie en inox.
- …
Notes et références
- [1] : la structure du diamant n’est pas exactement cubique, mais dérive du cubique face centrée avec en plus un atome dans chacune des diagonales ; appelé, justement, structure « cubique diamant ».
- [2] : ici quand je parle d’acier, il s’agit d’aciers simples, alliages de fer et de carbone, sans autre additif comme dans l’inox.
Références :
- Tempering (metallurgy) — Wikipedia ;
- Autenite — Wikipedia ;
- ELI5: Why is some stainless steel magnetic and other stainless steel is not magnetic? : explainlikeimfive ;
- Is stainless steel magnetic? - thyssenkrupp Materials ;
- Easy Inox | Le magnétisme de l’inox : mythes, réalité et applications.
Image d’en-tête de Google AI / Gemini.